ความร้อน
-พลังงานความร้อน
-พลังงานความร้อนกับการเปลี่ยนสถานะของสาร
-สมดุลความร้อน
-การถ่ายเทความร้อน
-สมบัติของแก๊สในอดมคติ
-กฎของบอยด์(Robert Boyle)
-กฎของชาร์ล(Charles’s law)
-กฎของเกย์-ลูกแซก(Gay-Lussac’s law)
-แบบจำลองของแก๊ส
-ทฤษฎีจลน์ของแก๊ส
-การหาอุณหภูมิผสมและความดันผสมจากทฤษฎีจลน์ของแก๊ส
-พลังงานภายในระบบ
-การประยุกต์
-ตัวอย่างการคำนวณ
ทฤษฎีจลน์ของแก๊ส
ก๊าซจำนวนหนึ่งมีความดัน 275 กิโลนิวตัน ปริมาตร 0.09 ลูกบาศก์เมตรและอุณหภูมิ 185 องศาเซลเซียส ถ้าเกิดการเปลี่ยนแปลงสภาวะที่มีความดันคงที่จนอุณหภูมิลดลงเหลือ 15 องศาเซลเซียส จงหาปริมาณความร้อนและงานที่ใช้โดยกำหนดให้ค่าคงที่เฉพาะของก๊าซ R = 0.29 kJ/kg-K
- ความดันขึ้นอยู่กับแรงที่กระทำระหว่างภาชนะกับโมเลกุลจากการชน*
สมมติให้มีแก๊ส N โมเลกุล แต่ละโมเลกุลมีมวล m อยู่ในภาชนะลูกบาศก์ยาวด้านละ l ปริมาตร V
ถ้าแก๊สโมเลกุลหนึ่งกำลังเคลื่อนที่ไปด้วยความเร็วตามแกน x เป็น
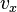 ไปชนกับภาชนะ เนื่องจากเป็นการชนแบบยืดหยุ่นสมบูรณ์ ความเร็วหลังชนจึงเป็น
ไปชนกับภาชนะ เนื่องจากเป็นการชนแบบยืดหยุ่นสมบูรณ์ ความเร็วหลังชนจึงเป็น  โมเมนตัมที่เปลี่ยนไปเป็น
โมเมนตัมที่เปลี่ยนไปเป็น 
แรงที่ผนังกระทำต่อแก๊ส
เวลานับจากที่แก๊สชนภาชนะด้านหนึ่งกลับมาชนที่เดิมอีกครั้งเป็น 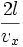
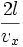
มีแก๊ส N โมเลกุล
ความดัน 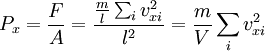 เนื่องจากแก๊สเคลื่อนที่ในสามมิติ ความเร็ว v จะได้
เนื่องจากแก๊สเคลื่อนที่ในสามมิติ ความเร็ว v จะได้
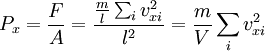 เนื่องจากแก๊สเคลื่อนที่ในสามมิติ ความเร็ว v จะได้
เนื่องจากแก๊สเคลื่อนที่ในสามมิติ ความเร็ว v จะได้
จะได้ว่า
เนื่องจากเป็นแก๊สในภาชนะเดียวกัน ความดันตามแนว x y z เท่ากันและเท่ากับความดันของแก๊ส
ให้  เป็นค่าเฉลี่ยกำลังสองของความเร็ว ซึ่งได้จาก
เป็นค่าเฉลี่ยกำลังสองของความเร็ว ซึ่งได้จาก
 เป็นค่าเฉลี่ยกำลังสองของความเร็ว ซึ่งได้จาก
เป็นค่าเฉลี่ยกำลังสองของความเร็ว ซึ่งได้จาก
เมื่อ  คือความหนาแน่นของแก๊ส
คือความหนาแน่นของแก๊ส
 คือความหนาแน่นของแก๊ส
คือความหนาแน่นของแก๊ส
หรือ จาก 

ก๊าซจำนวนหนึ่งมีความดัน 275 กิโลนิวตัน ปริมาตร 0.09 ลูกบาศก์เมตรและอุณหภูมิ 185 องศาเซลเซียส ถ้าเกิดการเปลี่ยนแปลงสภาวะที่มีความดันคงที่จนอุณหภูมิลดลงเหลือ 15 องศาเซลเซียส จงหาปริมาณความร้อนและงานที่ใช้โดยกำหนดให้ค่าคงที่เฉพาะของก๊าซ R = 0.29 kJ/kg-K



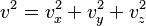



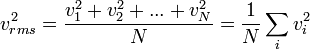

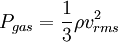

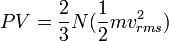

ไม่มีความคิดเห็น:
แสดงความคิดเห็น